Кинетика двухатомного газа
План:
Влияние электронного момента.
1.Введение. Простейшими молекулами газа являются двухатомные молекулы (частный случай идеального газа), представляющие устойчивое соединение двух различных атомов. Мы лишены возможности подробно разбирать вопрос о природе сил, приводящих к образованию молекул из свободных атомов, а также детально описывать движение атомов в молекулах. Поэтому мы ограничимся лишь поверхностной характеристикой молекул, приведя только те сведения, которые нам понадобятся для описания двухатомного газа (вращение молекул одинаковых и различных атомов, колебания атомов, влияние электронного момента).
Переходя к вычислению термодинамических величин двухатомного газа, прежде всего, укажем, что подобно тому, как одноатомные газы имеет смысл рассматривать лишь при температурах Т , малых по сравнению с энергией ионизации, двухатомный газ можно рассматривать как таковой лишь при условии малости Т по сравнению с энергией диссоциации молекулы. Это обстоятельство, в свою очередь приводит к тому, что в статистической сумме надо учитывать лишь нормальный электронный терм молекулы. Мы начнем с изучения наиболее важного случая, когда в своем нормальном электронном состоянии молекула газа не имеет ни спина, ни орбитального момента вращения относительно оси (S=О, Λ=0); такой электронный терм не обладает, конечно, тонкой структурой. Кроме того, следует различать случаи молекул, составленных из различных атомов (в том числе различных изотопов одного и того же элемента), и молекул, состоящих из одинаковых атомов, ибо последний случай обладает некоторыми специфическими особенностями. Мы будем считать, что молекула состоит из различных атомов. Как известно, уровень энергии двухатомной молекулы складывается в известном приближении из трех независимых частей—электронной энергии (в которую включают также и энергию кулонового взаимодействия ядер в их равновесном положении и которую мы будем отсчитывать от суммы энергий разведенных атомов), вращательной энергии и энергии колебаний ядер внутри молекулы. Для синглетного электронного терма эти уровни могут быть написаны в виде:
(1)
значение расстояния между ядрами). При подстановке выражения (1) в статистическую сумму последняя распадается, очевидно, на три независимых множителя:
где “вращательная” и “колебательная” суммы определяются как
(3)
(4)
вращательных уровней по направлениям момента К. Соответственно, свободная энергия представится в виде суммы трех частей:
(5)
m = — масса молекулы). Первый член можно назвать поступательной частью F пос (поскольку он связан со степенями свободы поступательного движения молекул), а
— вращательной и колебательной частями. Поступательная часть всегда выражается формулой типа (43,1) 1 с постоянной теплоемкостью С пос =3/2 и химической постоянной:
(7)
Полная теплоемкость газа запишется в виде суммы нескольких членов:
(8) каждый из которых связан с тепловым возбуждением соответственно поступательного движения молекулы, ее вращения и колебаний атомов внутри молекулы. Займемся вычислением свободной вращательной энергии. Если температура настолько высока, что
(“вращательный квант” ћІ/2 I мал по сравнению с T) 1 ), то в сумме (3) основную роль играют члены с большими К. Но при больших значениях К вращение молекулы квазиклассично. Поэтому в этом случае статистическая сумма Zвр может быть заменена соответствующим классическим интегралом:
(9) где ε(М)—классическое выражение кинетической энергии вращения как функции момента вращения М. Вводя связанную с молекулой вращающуюся систему координат ξ , η , ζ , с осью ζ , вдоль оси молекулы и, имея в виду то, что двухатомная молекула обладает двумя вращательными степенями свободы, а момент вращения линейной механической системы перпендикулярен к ее оси, пишем:
ε(M)= (10) Элемент dτ вр есть деленное на (2лћ) 2 произведение дифференциалов dM ξ dM η и дифференциалов соответствующих M ξ и M η “обобщенных координат”, т. е. бесконечно малых углов поворота вокруг осей ξ θ η: d φ ξ d φ η 1 ). Но произведение двух бесконечно малых углов поворота вокруг осей ξ и η есть не что иное, как элемент телесного угла d 0ζ для направления третьей оси ζ; интегрирование по телесному углу даст 4π. Таким образом, имеем 2 ):
Z вр =4π/(2πž )І = =2IT/ћІ Отсюда свободная энергия F вр =-NT ln T-NT ln 2I/ћІ (10) Таким образом, при рассматриваемых не слишком низких температурах вращательная часть теплоемкости оказывается постоянной и равной C вр =1 в соответствии с общими результатами классического рассмотрения идеального газа (по Ѕ на каждую вращательную степень свободы). Вращательная часть химической постоянной равна ξ вр =ln(2I/ћІ). Мы увидим ниже, что существует значительная область температур, в которой выполнено условие T>>ћІ/2I и в то же время колебательная часть свободной энергии, а с нею и колебательная часть теплоемкости отсутствуют. В этой области теплоемкость двухатомного газа равна C ν =C пос +C вр , т.е. C ν =5/2, С p =7/2, (11) а химическая постоянная ξ = ξ пос + ξ вр :
(12) В обратном предельном случае низких температур T<<ћІ/2I достаточно сохранить два первых члена суммы: Z вр =1+3exp(-ћІ/IT), и для свободной энергии получим в том же приближении: F вр =-3NTexp(-ћІ/IT). (13) Отсюда энтропия S вр =3N ћІ/(IT)[exp(-ћІ/IT)](1+ IT/ ћІ) (14) и теплоемкость С вр =3N(ћІ/IT) І exp(-ћІ/IT). (15)
Следовательно, двухатомный газ ведет себя как одноатомный; C вр как его теплоемкость, так и химическая постоянная имеют те же значения, которые имел бы одноатомный газ с части- цами массы m. В общем случае произвольных 2IT/ ћІ температур сумма Z вр должна вычисляться численно. На рис. 1 приведен график С вр как функции от 2IT/ ћІ. Вращательная теплоемкость Рис. 1. имеет максимум, равный 1.1 при T=0.81(ћІ/2I), после чего асимптотически приближается к классическому значению 1 1 ). 3. Двухатомный газ. Колебания атомов. Колебательная часть термодинамических величин газа становится существенной при значительно более высоких температурах, чем вращательная, потому что интервалы колебательной структуры термов велики по сравнению с интервалами вращательной структуры 1 ). Мы будем считать, однако, температуру большой лишь настолько, чтобы были возбуждены в основном не слишком высокие колебательные уровни. Тогда колебания являются малыми (а потому и гармоническими), и уровни энергии определяются обычным выражением Ћω( v +1/2) использованным в (4). Вычисление колебательной статистической суммы Z кол (4) производится элементарно. Вследствие очень быстрой сходимости ряда суммирование можно формально распространить до v = оо. Условимся
Рис. 2. отсчитывать энергию молекулы от наиболее низкого ( v =0) колебательного уровня (т. е. включаем ћω/2 в постоянную ε 0 в (1)). Тогда имеем:
(21)
(22)
(23)
(24)
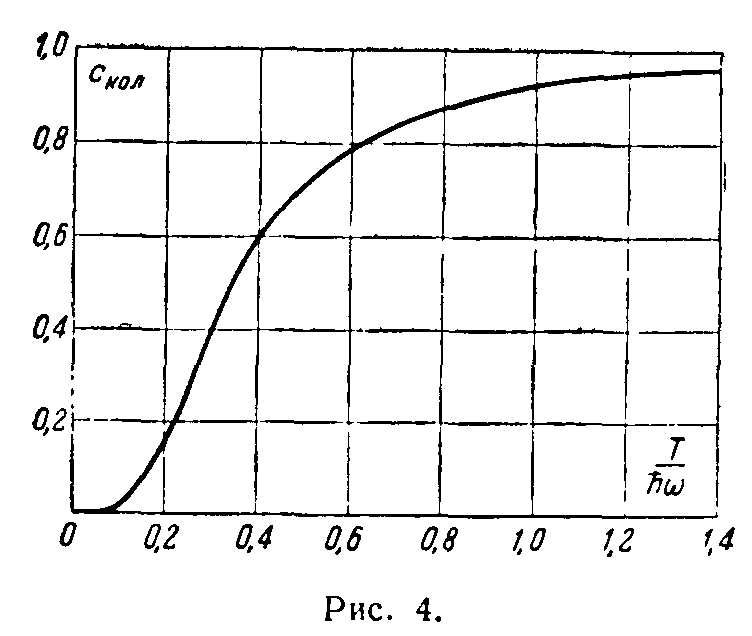
На рис. 2 изображен график зависимости С кол от T/ћω. При низких температурах (ћω>>T) все эти величины стремятся экспоненциально к нулю:
(25)
(26)
чему соответствует постоянная теплоемкость С кол =1 1 ) и химическая постоянная ξ кол =-lnћω. Складывая со значениями (11), (12), найдем, что при температурах T>>ћω полная теплоемкость двухатомного газа равна 2 )
(27)
(28) В этой формуле для молекул из одинаковых атомов множитель [(2)] должен быть опущен. Первые два члена разложения E кол равны
(29) Появление здесь постоянного члена — 1/2Nћω связано с тем, что, мы отсчитываем энергию от низшего квантового уровня (т. е. от энергии “нулевых колебаний”), между тем как классическая энергия должна была бы отсчитываться от минимума потенциальной энергии. Выражение (26) для свободной энергии можно, конечно, получить и классическим путем, поскольку при T>>ћω существенны большие квантовые числа V, для которых движение квазиклассично. Классическая энергия малых колебаний с частотой ω имеет вид
( т'— приведенная масса). Интегрирование с этим выражением для ε даст для статистического интеграла значение
(30)
соответствующее (26) 1 ) (ввиду быстрой сходимости интеграла интегрирование по dq можно вести в пределах от -∞ до +∞). При достаточно высоких температурах, когда возбуждены колебания с большими v, могут стать существенными эффекты ангармоничности колебаний и взаимодействия колебаний с вращением молекулы (эти эффекты, принципиально, одного порядка). Благодаря тому, что v велико, соответствующая поправка к термодинамическим величинам может быть определена классическим путем. Рассмотрим молекулу как механическую систему двух частиц, взаимодействующих по закону U(r), в системе координат, в которой покоится их центр инерции. Энергия (функция Гамильтона), описывающая классически точным образом вращение и колебания системы, есть сумма кинетической энергии (как энергии частицы с приведенной массой т' ) и потенциальной энергии U(r). Статистический интеграл после интегрирования по импульсам сводится к интегралу по координатам:
а после интегрирования по углам (в сферических координатах) остается интеграл
Приближение, соответствующее независимым гармоническим колебаниям и вращению молекулы, получается, если положить U(r)=U 0 +1/2m′ω² (r-r 0 )І , и при интегрировании заменить медленно меняющийся множитель rІ на г 0 2 , где r 0 —равновесное расстояние между обеими частицами; U 0 =U(r 0 ). Чтобы учесть ангармоничность колебаний и их взаимодействие с вращением, пишем теперь
(31) ( ξ= (r/r 0 )—1, α θ β — οξ стоянные) и затем разлагаем все подин-тегральное выражение, выделив из него множитель
по степеням ξ . Β π азложении надо сохранить члены, дающие после интегрирования лишь первую после основной степень температуры; интегрирование по d ξ , производится в пределах от -∞ до +∞.
Нулевой член разложения дает обычное значение статистического интеграла, а все остальные — искомую поправку. Опуская промежуточные вычисления, приведем окончательный результат для поправки к свободной энергии:
(32) Таким образом, эффекты ангармоничности колебаний (и их взаимодействия с вращением) приводят к поправке в свободной энергии, пропорциональной квадрату температуры. Соответственно, к теплоемкости прибавляется член, пропорциональный первой степени температуры.
4. Двухатомный газ. Влияние электронного момента. Некоторые (правда, весьма немногочисленные) молекулы обладают в своем нормальном электронном состоянии отличным от нуля орбитальным моментом или спином. Существование отличного от нуля орбитального момента Λ приводит, как известно, к двукратному вырождению электронного терма, соответственно двум возможным направлениям этого момента относительно оси молекулы 1 ). Это обстоятельство отразится на термодинамических величинах газа в том отношении, что благодаря удвоению статистической суммы к химической постоянной добавится величина
(33) Наличие не равного нулю спина S приводит к расщеплению на 2S+1 термов; интервалы этой тонкой структуры, однако, настолько ничтожны (при Λ=0), что при вычислении термодинамических величин ими можно всегда пренебречь. Наличие спина приводит лишь к увеличению кратности вырождения всех уровней в (2S+1) раз, соответственно чему к химической постоянной добавится величина
(34) Особого рассмотрения требует тонкая структура, возникающая при S≠0, Λ ≠0 . Θν тервалы тонкой структуры при этом могут достигать значений, делающих необходимым их учет при вычислении термодинамических величин. Выведем формулы для случая дублетного электронного терма 2 ).
Каждая компонента электронного дублета имеет свою колебательную и вращательную структуру, параметры которой для обеих компонент можно считать одинаковыми. Поэтому в статистической сумме (2) появится еще один множитель:
где g 0 ,g 1 ,—кратности вырождения компонент дублета, Δ—расстояние между ними. К свободной энергии соответственно прибавится “электронная” часть, равная
Выпишем также “электронную” теплоемкость, которая должна быть добавлена к остальным частям теплоемкости:
(36)
В обоих пределах Т→ 0 и Т→ ∞ С эл , естественно, обращается в нуль, а при некоторой температуре Т~∆ имеет максимум.
Литература:
М. Наука. 1969
Поделитесь этой записью или добавьте в закладки |
Полезные публикации |
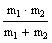 Здесь —электронная энергия, ћω—колебательный квант,
v—
коле-бательное квантовое число, K—вращательное квантовое число (мо-мент вращения молекулы, I= m'
—момент инерции молекулы (m'= приведенная масса обоих атомов, —равновесное
Здесь —электронная энергия, ћω—колебательный квант,
v—
коле-бательное квантовое число, K—вращательное квантовое число (мо-мент вращения молекулы, I= m'
—момент инерции молекулы (m'= приведенная масса обоих атомов, —равновесное
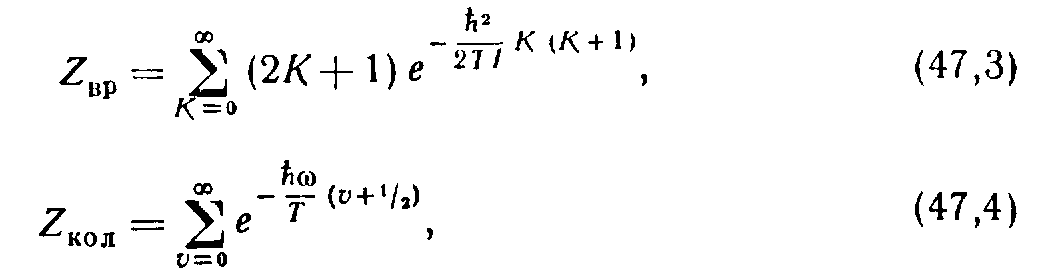
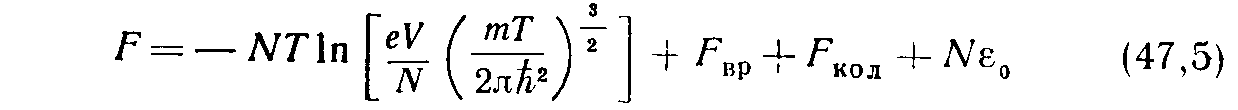
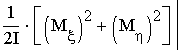
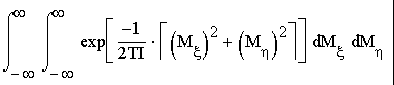
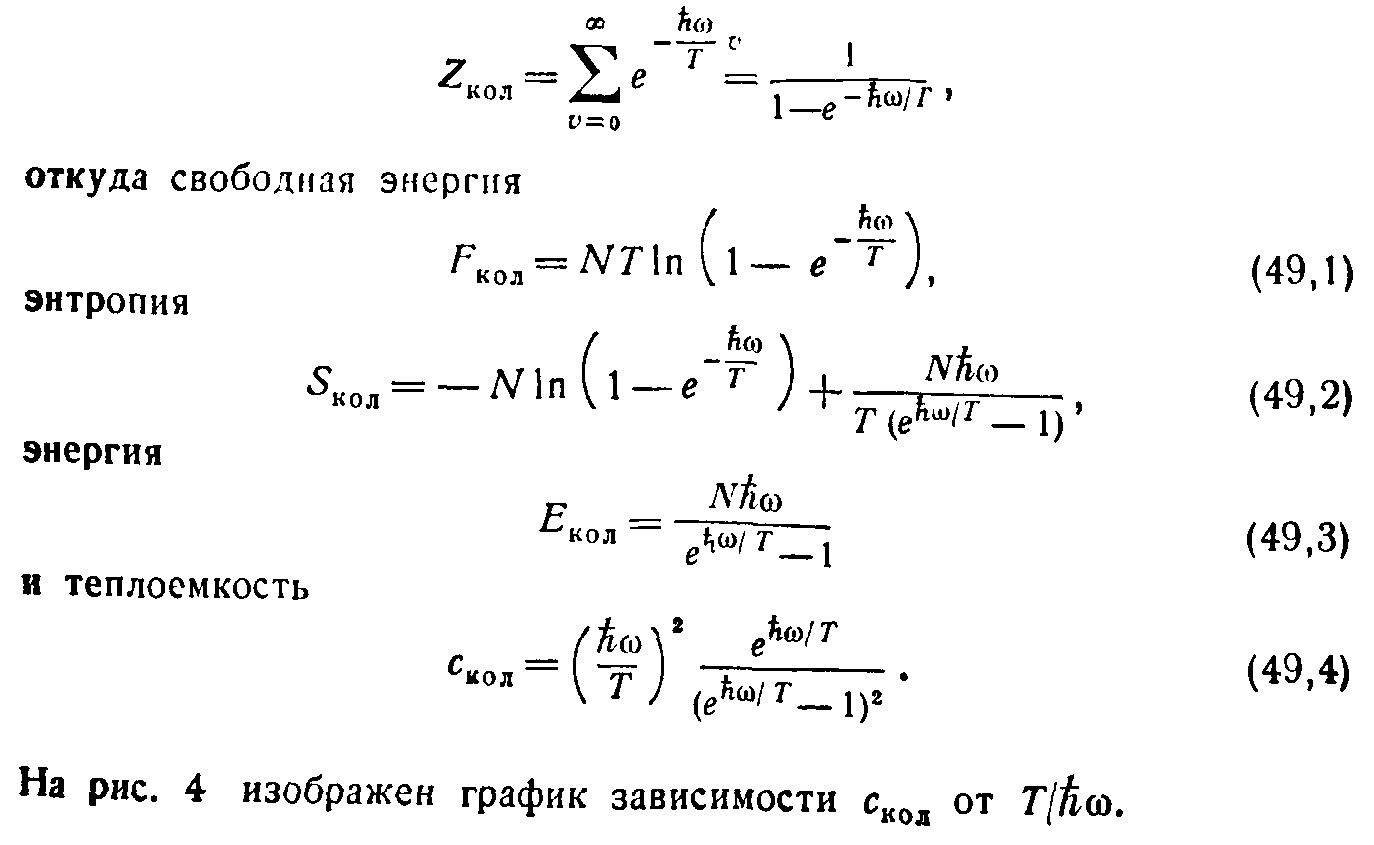
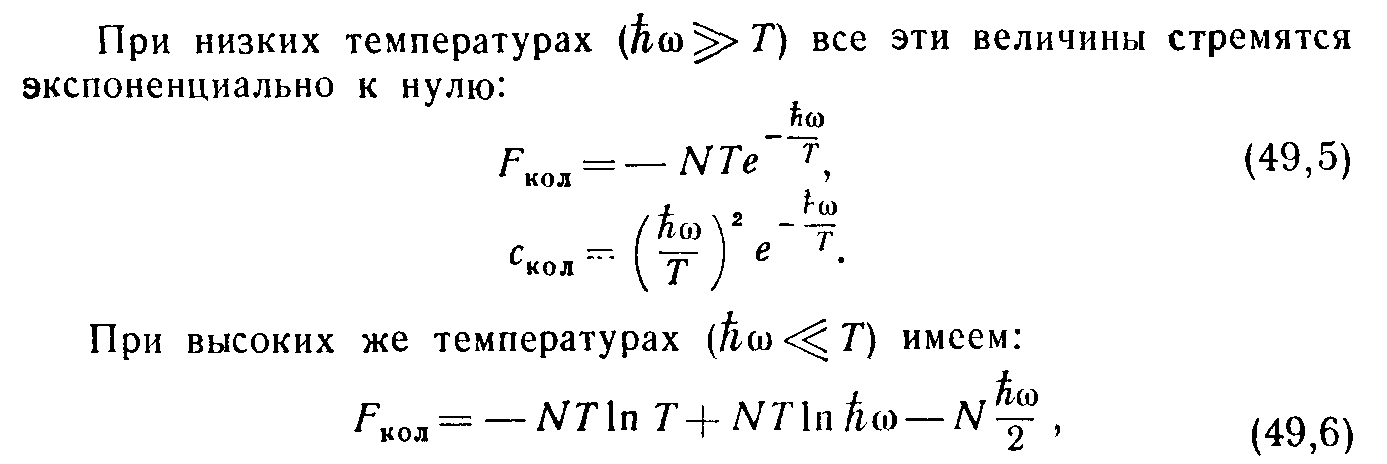
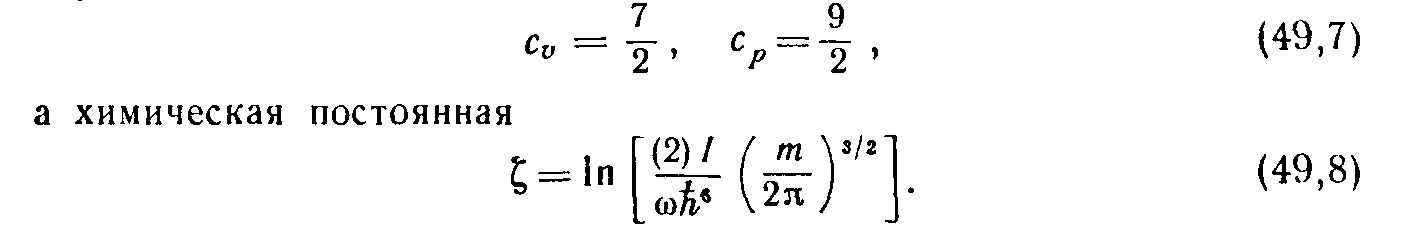
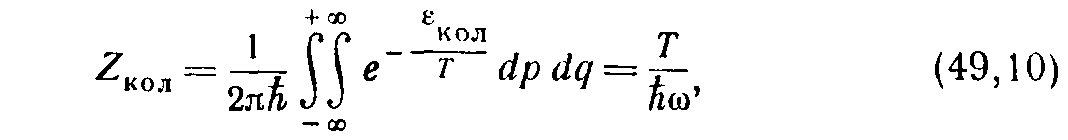
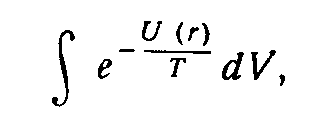
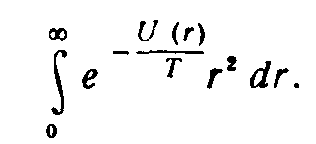
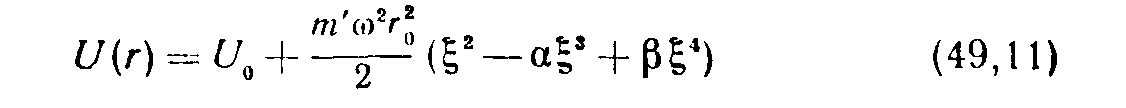
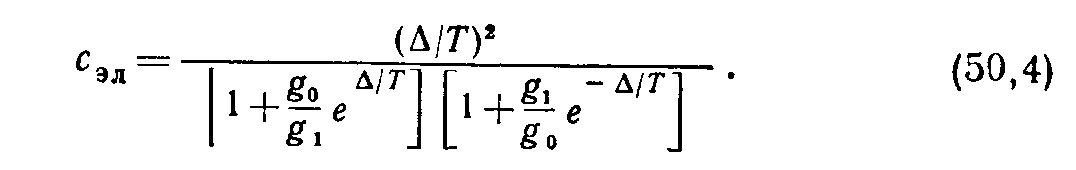
 Главная
Главная